Kada kazemo pH vrednost vode ,mnogima to poznato zvuci i svi ce odmah pomisliti na kiselost vode. Sta je u stvari ph vrednost?
pH vrednost je jacina kiseline ili baze za datu koncentraciju. U vodi imamo nosioce kiselih ili baznih ( alkalnih ) osobina. Ako ih ima podjednako , voda reaguje neutralno (destilovana voda).
Za odredjivanje kiselosti ili alkalnosti koristimo skalu koja se krece od 0-14.
0 - 7 mere kiselosti
7 - neutralnost
7-14 mere alkalnosti
Najznacajnije ph vrednosti za nas akvariste krecu se od 5.5 do 9.0 Moramo znati da svaki stepen ispod ili iznad neutralnosti 7 je deset puta veci ili manji od prethodnog stepena. Primer : ph 5 ima deset puta jacu kiselost od pH 6 a sto puta od od ph 7 (neutralne) Zato moramo voditi racuna kod odredjivanja ph vrednosti ako zelimo da smanjimo ili povecamo.
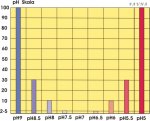
Evo jedne skale gde mozemo videti kolika su velika ostupanja izmedju malih vrednosti:
pH vrednost je jacina kiseline ili baze za datu koncentraciju. U vodi imamo nosioce kiselih ili baznih ( alkalnih ) osobina. Ako ih ima podjednako , voda reaguje neutralno (destilovana voda).
Za odredjivanje kiselosti ili alkalnosti koristimo skalu koja se krece od 0-14.
0 - 7 mere kiselosti
7 - neutralnost
7-14 mere alkalnosti
Najznacajnije ph vrednosti za nas akvariste krecu se od 5.5 do 9.0 Moramo znati da svaki stepen ispod ili iznad neutralnosti 7 je deset puta veci ili manji od prethodnog stepena. Primer : ph 5 ima deset puta jacu kiselost od pH 6 a sto puta od od ph 7 (neutralne) Zato moramo voditi racuna kod odredjivanja ph vrednosti ako zelimo da smanjimo ili povecamo.
Evo jedne skale gde mozemo videti kolika su velika ostupanja izmedju malih vrednosti: